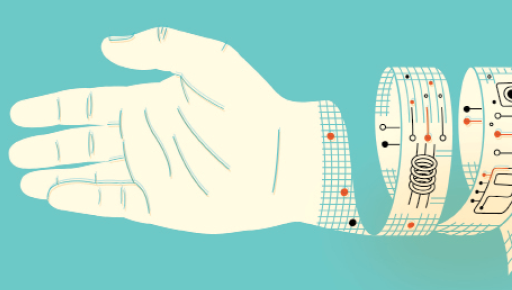
لن تكون المواد الجديدة مجرد غطاء بسيط للجروح،
إنها ستنذر الأطباء بالمشكلات فيها وتوصل الأدوية إليها.
يمكن تحويل ضمادات الجروح إلى أنظمة دقيقة لإيتاء الأدوية بمعالجة مواد بحجم بضعة أجزاء من البليون من المتر (نانومتراتnanometers).
وتمكِّن التقانة النانوية الباحثين من وضع الأدوية في «شطائر» بين طبقتين من الضماد، وضبط مدى إطلاقها.
ويمكن للضمادات الحساسة كشف حالات الجروح الخطيرة. ويمكنها أيضا إطلاق جزيئات تعيق بروتينات مسببة لمشكلات.
ويمكن وضع أدوات صغيرة ذات طبقات في شرايين القلب، وتؤدي إذابة طبقات إلى إطلاق دنا DNA لبروتين يساعد على إعادة بناء الأوعية الدموية المتضررة.
لقد عولج جيدا الجنود المصابون بعد عودتهم من القتال في أفغانستان؛ ففي مركز سان أنطونيو الطبي العسكري بتكساس، قام الجراحون بتطعيم نسيج سليم بعناية فائقة على حروقهم وجروحهم باستخدام جراحة مجهريةmicrosurgery لوصل أوعيتهم الدموية بالجلد الجديد. لكن المرضى ما زالوا يواجهون عدم يقينية التحسن، فالأوعية قد لا تزود الأكسجين بما يكفي لنجاح الطعوم.
وعندما زار <C. إيڤانس>(١) سان أنطونيو في عام 2010 ورأى هؤلاء الجنود، أدرك أن التقنيات التقليدية لمراقبة مستويات الأكسجين لم تعمل بشكل جيد جدا، وأنها غالبا ما أخفقت في إعطاء تحذير كاف عند فشل الطعم. ويقول <إيڤانس>: «ما فعله هؤلاء الأطباء مذهلٌ حقا، لكن المشعرات التي يمتلكونها ليست قاطعة.»
ولذلك صمم <إيڤانس> ضمادا أفضل، فقد بدأ مع زملائه بصباغات تتفاعل مع المستويات المختلفة من الأكسجين، وأضافوا جزيئات نانوية الحجم تضبط فاعلية الصباغ، واستخدموها لتكوين ضماد سائل يشير إلى صحة الجرح الذي يغطيه. وفي هذا الصدد، يقول <إيڤانس>: «إن الضماد يتغير لونه، كضوء عابر، من الأخضر عبر الأصفر والبرتقالي إلى الأحمر وذلك حسب كمية الأكسجين المزود.» وبعد نجاح التجارب على الضماد السائل الجديد على حيوانات المختبر في عام 2014، تقرر بدء التجارب على البشر في هذا العام.
وباستغلال الإمكانات المكتشفة حديثا على معالجة مواد يصل صغر حجمها إلى بضعة أجزاء من البليون من المتر، لا يستطيع علماء مثل <إيڤانس> تحسين التقييمات الصحية السريعة فحسب، بل يمكنهم أيضا تحويل ضمادات الجروح إلى أنظمة دقيقة لإيتاء الأدوية. وتقول <P. هاموند> [الكيميائية من المعهد MIT]: «تؤدي التقانة النانوية دورا كبيرا من خلال قدرتها على ضبط الكميات المتحررة وكذلك مدى جودة الصياغات المطلوب وصولها إلى منطقة الجرح.» ولهذه الدقة ميزةٌ كبيرة مقارنةً بمجرد طلاء أجزاء من الجسم بأدوية لن يصل إلا القليل منها إلى هدفه.
خروج إلى الهواء(**)
يعاني أكثر من ستة ملايين شخص في الولايات المتحدة سنويا سوءَ اندمال الجروح، مع تكاليف طبية تقدر بنحو 25 بليون دولار. نموذجيا يقوم الأطباء بلصق إلكترودات إبرية needle electrodes بالنسيج المصاب لقياس مدى أكسجة oxygenation هذا النسيج، لكن الإبر قد تكون مؤلمة وتُعطي قراءات من نقطة واحدة فقط من جرح كبير. أما ضماد <إيڤانس>، فيمكن أن يُعطي خريطة فورية للأكسجين في الجرح بكامله.
ويعتمد ضماد <إيڤانس> على صباغين ممزوجين في ضماد سائل سريع الجفاف يمكن فرشه على الجروح. وأي هبّةٍ قصيرة للضوء الأزرق تُنشِّط الصِباغين فيومضان: يعطي الصباغ الأول توهجات حمراء ناصعة، والآخر توهجات خضراء. وتعمل جزيئات الأكسجين على إطفاء ومضان الصباغ الأحمر، ولذا سيبدو الضماد أخضر اللون إذا كان النسيج المجاور مغمورا بالأكسجين وصحيا. أما إذا حُرِمت مناطق من الجرح من الأكسجين، فستلمع من خلال الضماد بقعٌ باللون الأصفر فالبرتقالي، ومن ثم الأحمر المنذر بالخطورة.
ومفتاح الإنذار هو إضافة نانوية الحجم إلى جزيئات الصباغ الأحمر. وقد قَرَنَ <إيڤانس> كلاًّ من هذه الجزيئات بجزيء تغصني شبيه بالشجرة(2) له بنية متفرعة تمتد نحو 2 نانومتر. وتمنع هذه الأجمةُ(3) thicket الجزيئيةُ الجزيئاتِ المتجاورة من التداخل وإخماد إحداها للومضان الفسفوري للآخر. كما تمنع هذه الجزيئات بعض جزيئات الأكسجين، وليس كلها، من الوصول إلى الصباغ؛ وابتداء من المستويات الأدنى تجعل أي تغيير أكثر وضوحا.
وفي المستشفى، يفترض أن يُنذر اللونُ الأحمر التحذيري الممرضةَ لتصوير الضماد، والأطباءَ لمحاولة تحسين توزع الدم والأكسجين في مواضع الاضطراب. ومن حيث المبدأ، يمكن أن يُعمَل الضماد في المنزل، يقول <إيڤانس>: «يمكن للمرضى أن يأخذوا لقطات من ضماداتهم الخاصة ويرسلوها إلى الطبيب للتقييم.»
لقد ابتكر فريق <إيڤانس> صباغات بديلة أيضا أكثر كفاءة في تحويل الضوء الأزرق إلى أحمر. ويقول <إيڤانس>: «ضمادنا الجديد لامعٌ جدا بحيث تمكن رؤيته بتحميل صباغي منخفض جدا، في غرفة مضاءة بضوء الشمس». ويضيف: «في المستقبل، يمكن هندسة الضماد ليقوم حتى بتوزيع أدوية علاجية على الجروح.»
ضماد إيصال الأدوية(***)
وفي مختبر <هاموند>، قام الباحثون فعلا بتحميل الضمادات بمواد علاجية مهندسة نانويا. وقد طوروا طلاءات تطلق ببطء جزيئاتٍ من رنا RNA أو بروتينات يمكنها إيقاف نشاطات خلوية معينة قد تعيق شفاء الجروح. ويمكن لبعض جزيئات رنا، وتسمى جزيئات الرنا التدخلية الصغيرة(4)، أن تعيق، على سبيل المثال، مقدرة جينات تؤدي إلى بروتينات مسببة لبعض المشكلات.
سيظهر الضماد باللون الأخضر إذا كان نسيج الجرح مغمورا بالأكسجين وصحيّا. أما إذا حرمت مناطق من الجرح من الأكسجين، فستلمع من خلال الضماد بقعٌ باللون الأصفر والبرتقالي، ومن ثم باللون الأحمر المنذر بالخطر. ألوان
لقد غلف فريق <هاموند> بعض جزيئات رنا هذه ضمن «قذائف»(5) من فوسفات الكالسيوم يبلغ عرض كل منها نحو 200 نانومتر، ثم حصروا هذه القذائف، كشطيرة، بين طبقتين من پوليمر(6) polymer مشحون إيجابيا ومصنوع من جزيئات حيوية، ومن ثم دهنوا أحد جانبي هذه الشطائر بصلصال مشحون سلبيا. (تؤدي الشحنات المتعاكسة إلى التصاق الطبقات فيما بينها.) وتكديس حتى 25 من هذه الشطائر شَكَّل غطاء تصل سماكته نحو نصف ميكرون، وضعه مختبر <هاموند> على ضماد نايلون تقليدي.
ولأن الإنزيمات الطبيعية في الجسم تحطّم الطبقات، تُفرغ الضمادةُ جزيئاتِ الرنا إلى الجرح على مدى أسبوع. والإطلاق الثابت البطيء يمكن أن يُخفّض التأثيرات الجانبية التي قد تسببها الجرعة المفردة الكبيرة من الدواء التقليدي؛ كما يمكن أن تضمن هذه الطريقة في الإطلاق معالجةً ثابتة للجروح.
استعملت <هاموند> أيضا ما يسمى تغطية طبقة – طبقة(7) لتزويد بروتين علاجي يساعد على شفاء الجرح في الفئران المصابة بداء السكري. إن هذا البروتين متوفر أصلا على شكل مرهم، لكنها تقول إن صياغته ليست فعالة جدا – فبعد إيتائه دفعة أولية ضخمة من البروتين، يبهت نشاطه خلال 24 ساعة. بالمقابل، فضماد <هاموند> يسمح باستدامة تدفق ثابت على مدى خمسة إلى سبعة أيام لصيانة الجرعة المثلى من البروتين.
ويمكن لاستراتيجية طبقة – طبقة أن تحسن المعالجات لمرض آخر: مرض الشريان التاجي (الإكليلي) الذي يسببه تراكم لويحة في الأوعية الدموية التي تحمل الدم خلال عضلة القلب. وتتضمن المعالجة عادة توسيع الشريان ببالون قابل للنفخ وإبقائه مفتوحا بإدخال إنبوب صغير من شبكة من الفولاذ المقاوم للصدأ يعرف بالدعامة stent. وتأتي بعض الدعامات محملةً بجزيئات علاجية لمنع الشريان من التضيق ثانية، لكن المرضى حينها يجب أن يأخذوا أدوية أكثر لخفض الاختطارات المرتبطة بهذه العملية، أيْ خثرات الدم blood clots التي يمكن أن تتحرّر من المنطقة.
دارات كهربية ناعمة لا تمزق
اللحم وتغلف الأعضاء الحيوية وتراقبها.
كانت ملاءمة الأجهزة في عالم الإلكترونيات للحم البشر الطري ضعيفة، فالدارات الصلبة ليست قابلة للانثناء بما يناسب أعضاء الجسم المرنة، وحوافها القاسية تمزق الأنسجة الرخوة. وهذه المشكلة حدّت كثيرا من الجهود المبذولة لتحسين أدوات مثل قثاطر catheters تنقية الشرايين عبر إضافة آليات الضبط والدقة. وقد يدعم السيليكون صناعة الحواسيب بالكامل، لكنه هشٌّ جدا.
ومع ذلك، فحتى أكثر المواد قساوة تصبح مرنة إذا جعلتها رقيقة بما فيه الكفاية، حسب قول <J. روجرز> [أحد علماء المواد من جامعة إيلينويز في أوربانا-شامبين]. إنه يبني وريقات إلكترونية قابلة للتمدد بسماكة 10 نانومترات فقط، لأدوات يمكن أن توضع ضمن أعضاء كالقلب أو حولها، وتقوم بوظائفها من دون أن تسبب أي أذى. ويدعوها <روجرز> «إلكترونيات ناعمة(9).»
ويجب أن تستخدم الدارات التي يصممها <روجرز> موصلات عالية الدقة مثل السيليكون ونتريدات الگاليوم galliumnitride؛ لأنها يجب أن تؤمن النقل التناوبي لإشارات الحاسوب من دون خلل. وللالتفاف على ميل السيليكون إلى الانكسار عند ثنيه، استخدم <روجرز> الهندسة النانوية لترقيق المادة مع الحفاظ على قدرتها التوصيلية. فمع تنعيمه إلى نحو 10 نانومترات، يصبح السيليكون كرباط مطاطي أكثر من كونه شبيها بالزجاج.
لقد نجح <روجرز> في اختبار فعلي على الحيوانات لغشاء مرن مُضمَّن بالإلكترونيات ويمكنه أن يلتف حول القلب النابض لمراقبة النظميات rhythms الشاذة. وإذا واصلت الاختبارات إظهار نجاحات، فإنه يتصور إضافة مراقبات إلكترونية إلى أدوات فتح الشرايين، كقثطارات بالونية balloon catheters، بحيث يمكنها تحسس الأجزاء المتضيقة من الأوعية الدموية. ويقول <روجرز>: «أدوات ميكانيكية صماء يمكن أن تصبح هذه الأدوات أدوات جراحية متطورة.»
لطيفٌ على القلب
ومعالجة الشريان بجرعات من دنا يتم إيصالها بعناية بوساطة أدوات ذات طلاءات نانوية القياس nanoscaleيمكن أن توفر حلاًّ أفضل وفق ما يقول <D. لين> [الكيميائي من جامعة ويسكونسن-ماديسون]. ففي داخل الجسم، يمكن أن يجعل الدنا الخلايا تنتج بروتينا يساعد على ثباتية جدران الأوعية الدموية وإعادة بنائها. ولإيصال مثل هذه المعالجات الجينية في الزمان والمكان المطلوبين بالضبط، قام <لين> بطلاء الدعامات stents بطبقات متعاقبة من دنا وپوليمر (مكثور) قابل للتدرك الحيوي biodegradable، وتبلغ سماكة كل من هذه الطبقات عدة نانومترات. وبتغيير عدد الطبقات، يمكن أن يضبط الباحثون كمية الدنا المنطلقة إلى جدران الأوعية الدموية. وقد أظهرت التجارب على الخنازير أن الدنا اخترق تدريجيا النسيج المحيط في أثناء الأيام التالية بعد زرع الدعامة. وتُظهِر اختبارات أخرى أن الضبط الدقيق لتصميم الطلاء يمكن أن يغير معدل الإطلاق؛ يقول <لين>: «لدينا الآن ضبط معقول يسمح لنا بتحديد مدة الإطلاق من ثوان إلى شهور، وذلك من خلال تعديل بنية الپوليمر أو طريقة تجميع الفيلم».
ويمكن تكييف الهندسة النانوية الأساسية وراء هذه الاختراعات لتناسب تشكيلة واسعة من التطبيقات الأخرى. ويستعمل <لين> طلاءات پوليمرية لإيصال جزيئات حيوية تُسمى پپتيدات peptides تُقاطع «المحادثات الكيميائية» بين الجراثيم. وبفصلها عن بعضها، لا تستطيع الجراثيم الانضمام لتشكيل الطبقات الحيوية القاسية التي تقاوم فصلها بالمضادات الحيوية. ويستخدم <إيڤانس>، من جهته، صباغاته الفسفورية في عينات الأنسجة لتمييز الخلايا الورمية قليلة الأكسجين، والتي يمكن أن تكون خصوصا مقاومة للعلاج الكيميائي، ويخطط <إيڤانس> لاختبار التقنية على الحيوانات في وقت لاحق من عام 2015. ويمكن أن تستخدم مقاربة الصباغات أيضا لكشف وجود البكتيريا المعدية في نسيج الجرح أو كشف أنواع أخرى من الجزيئات. «حقا، اكتشافات بلا حدود،» على حد قول <إيڤانس>.
المؤلف
|
Mark Peplow |
|
|
<پيپلو> صحافي علمي من كامبريدج بإنكلترا. |
 |
مراجع للاستزادة
Polyelectrolyte Multilayers Promote Stent-Mediated Delivery of DNA to Vascular Tissue. Eric M. Saurer et al. in Biomacromolecules, Vol. 14, No. 5, pages 1696–1704; May 13, 2013.
Nanolayered siRNA Dressing for Sustained Localized Knockdown. Steven Castleberry in ACS Nano, Vol. 7, No. 6, pages 5251–5261; June 25, 2013.
Surface Coatings That Promote Rapid Release of Peptide-Based AgrC Inhibitors for Attenuation of Quorum Sensing in Staphylococcus aureus. Adam H. Broderick et al. in Advanced Healthcare Materials, Vol. 3, No. 1, pages 97–105; January 2014.
Click-Assembled, Oxygen-Sensing Nanoconjugates for Depth-Resolved, Near-Infrared Imaging in a 3 D Cancer Model. Alexander J. Nichols in Angewandte Chemie International Edition, Vol. 53, No. 14, pages 3671–3674; April 1, 2014.
Non-Invasive Transdermal Two-Dimensional Mapping of Cutaneous Oxygenation with a Rapid-Drying Liquid Bandage. Zongxi Li in Biomedical Optics Express, Vol. 5, No. 11, pages 3748–3764; November 1, 2014.
(*)A SMARTER BANDAGE
(**)COMING UP FOR AIR
(***)DRUG-DELIVERY DRESSING
(****)Gentle on the Heart
(1) Coron Evans: الكيميائي من كلية هارڤارد الطبية ومركز ويلمان للطب الضوئي photomedicine في مستشفى ماساتشوستس العام.
(2) a dendrimer, a treelike molecule
(3) شبكة صغيرة من التغصنات.
(4) small interfering RNAs
(5) أو: محارات.
(6) أو: مكثور.
(7) layer-by-layer
(8) implants؛ أو: زروعات.
(9) soft electronics